Journal Club Novembre 2025 – proposé par Violaine MOREAU (BoRdeaux Institute of onCology – BRIC, U1312)
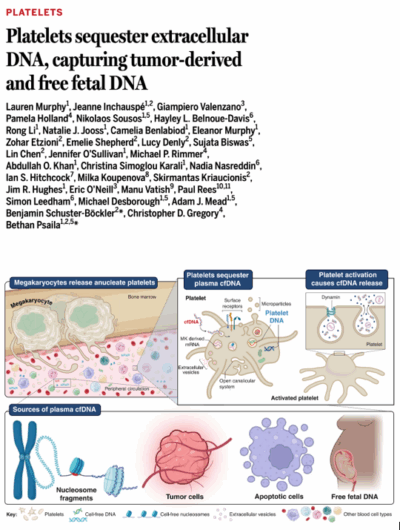
Cette étude d’une équipe anglo-saxonne (Université d’Oxford), publiée dans Science, montre que de l’ADN circulant issu de cellules tumorales peut être retrouvé au sein des plaquettes dans le sang. Cet ADN séquestré dans les plaquettes pourrait être informatif pour la détection et le diagnostic précoce des tumeurs. Comme les approches actuelles de biopsie liquide utilisent du plasma appauvri en plaquettes, d'importantes informations génétiques contenues dans les plaquettes sont perdues. Ainsi, en plus d’établir un rôle physiologique des plaquettes qui n'avait pas été mis en évidence auparavant, cet article met en avant une découverte à forte pertinence clinique.
Rationnel de l’étude :
Les plaquettes sont les cellules les plus petites et les deuxièmes plus abondantes dans notre sang. Elles contribuent à divers processus physiologiques, notamment l’hémostase, le maintien vasculaire et l’immunité innée. Les plaquettes n’ont pas de noyau et ont traditionnellement été considérées comme dépourvues d’ADN. Grâce à un réseau de canaux membranaires connectés à la surface, appelés système canaliculaire ouvert, les plaquettes ont la capacité à détecter et à internaliser les acides nucléiques exogènes, tels que l’ARN et l’ADN viraux, dans la circulation sanguine.
Lors d’une mitose anormale ou de la mort cellulaire, les cellules nucléées de l’organisme libèrent de l’ADN, ce qui entraîne la présence d’ADN « acellulaire libre » (cfDNA for cell-free DNA) dans le sang. Ainsi cet ADN est utilisé à visée diagnostique pour la détection de cancers, les tests prénataux et la surveillance du rejet de greffe. Les premières approches utilisaient l’analyse des variants génétiques pour identifier l’ADN circulant d’origine tumorale, fœtale ou provenant d’un donneur. Cependant, la proportion de fragments dans le plasma qui contiennent ces marqueurs génétiques informatifs est souvent faible, limitant l’utilisation de ces tests.
Les résultats :
1/ À l’aide d’une imagerie haute résolution et de cytométrie en flux, les auteurs montrent que les plaquettes issues de donneurs adultes sains contiennent de l’ADN génomique et que cet ADN se retrouve dans des vésicules intracellulaires CD81+/LAMP2+.
2/ Dans un contexte physiologique, l’étude montre que les plaquettes de femmes enceintes portant des bébés de sexe masculin contiennent des fragments du chromosome Y attestant que la séquestration de l’ADN libre par les plaquettes se produit in vivo, dans la circulation.
3/ La déplétion des plaquettes dans un modèle murin entraîne une augmentation de la quantité d’ADN libre dans le plasma des souris, suggérant un rôle des plaquettes dans l’élimination de l’ADN circulant. De même, une grande quantité d’ADN circulant a été retrouvée dans le plasma de patients atteints de purpura thrombocytopénique immunologique (PTI), caractérisé par une baisse anormale des plaquettes sanguines.
4/ L’internalisation de l’ADN, qui peut se faire à partir de l’ADN libre circulant ou à partir de l’ADN présent dans les vésicules extracellulaires, ne nécessite par l’activation des plaquettes et peut être modulée pharmacologiquement. En effet, l’internalisation de l’ADN libre se fait par endocytose et l’inhibition de l’exocytose plaquettaire augmente l’abondance de l’ADN obtenu à partir des plaquettes.
5/ Par des expériences de co-culture entre plaquettes issus de donneurs sains et cellules tumorales de différentes lignées (LS180, COLO205, HCT116, HEL), un transfert d’ADN génomique a été détecté dans les plaquettes, attesté par la présence de mutations spécifiques de chaque lignée.
6/ En utilisant des modèles murins de carcinogenèse (cancer colorectal et cancer pancréatique), ou du sang de patients avec des lésions pré-cancéreuses (polypes coliques précancéreux), l’étude montre que les mutations oncogéniques (KRASG12D, BRAFV600E) peuvent se retrouver dans l’ADN plaquettaire à des quantités supérieures que dans l’ADN circulant, attestant de l’utilité d’étudier cet ADN plaquettaire en cancérologie.
Conclusion :
Au-delà de l’ADN issu des pathogènes, l’étude montre que les plaquettes peuvent acquérir un répertoire de fragments d’ADN qui cartographient l’ensemble du génome nucléaire, y compris l’ADN provenant de cellules tumorales. Compte tenu de leur abondance, de leur facilité d’isolement et de leur perfusion dans tous les tissus, les plaquettes sont idéalement placées pour servir de biocapteurs des perturbations génétiques dans les tissus.
Cette découverte a une grande pertinence clinique et ouvre la voie à des travaux futurs visant à clarifier le rôle des plaquettes dans l’homéostasie de l’ADN libre circulant, ainsi que le devenir et les conséquences physiologiques des fragments d’ADN libérés sur les sites d’activation plaquettaire.
De plus, l’ADN plaquettaire pourrait constituer un réservoir de matériel génétique cliniquement pertinent, permettant d’augmenter la sensibilité du dépistage du cancer même lors de faibles charges tumorales.
