Journal Club Juillet 2025 – Proposé par Frédéric SALTEL (BoRdeaux Institute of onCology – BRIC, U1312)
Et si le fer, bien connu pour son rôle dans l’organisme, notamment pour le transport de l’oxygène ou pour le fonctionnement des enzymes, devenait un allié pour combattre les cancers les plus résistants ? C’est la promesse de cette étude dirigée par Raphaël Rodriguez (Institut Curie) et ses collègues et publié dans Nature en Juin 2025. Les auteurs montrent que le fer, une fois activé dans un organite précis de la cellule appelée lysosome, peut déclencher un type de mort cellulaire nommé ferroptose. Ce processus est une forme de nécrose cellulaire induite par l’accumulation létale de lipides peroxydés. Le fer réagit avec les peroxydes pour produire des radicaux centrés sur l’oxygène. Dans la cellule, un tel processus peut initier et propager une réaction en chaîne radicalaire qui conduit à des produits organiques oxydés, une chimie généralement définie comme la réaction de Fenton. Ce processus pourrait cibler de manière sélective certaines cellules cancéreuses très agressives et/ou résistantes aux traitements.
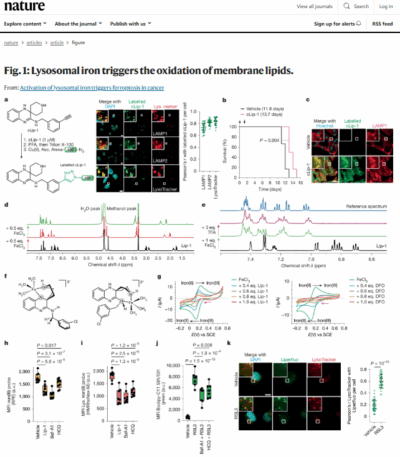
Tout d’abord dans cet article, les auteurs ont montré en utilisant une version marquée de la molécule Liproxstatine-1 (cLip-1), qui protège les cellules de la ferroptose, qu’elle s’accumule spécifiquement dans les lysosomes. Et si la ferroptose implique différents organites au niveau cellulaire, ici les auteurs montrent que c’est au niveau du lysosome que ce processus est initié.
Les cellules cancéreuses dans un état dit “de tolérance persistante aux traitements” (DTP) présentent une vulnérabilité accrue à la ferroptose. Ces cellules expriment fortement la protéine CD44, le récepteur à l’acide hyaluronique qui est surexprimé dans les cellules souches cancéreuses et les cellules métastatiques. De plus, CD44 favorise l’absorption de fer par endocytose. Cette accumulation de fer active des déméthylases dépendantes du fer, déclenchant des programmes épigénétiques associés à l’état DTP. Pour exploiter cette vulnérabilité, les chercheurs ont conçu une molécule bifonctionnelle nommée fentomycin 1 (Fento-1), combinant une molécule naturelle fluorescente (marmycin) ciblant la membrane plasmique et un ligand (Chen–White) activant le fer(II) en conditions acides comme dans les lysosomes. Une fois internalisée, Fento-1 induit l’oxydation des lipides membranaires, entraînant une ferroptose.
Des expériences montrent que Fento-1 cible spécifiquement les lysosomes, provoque l’oxydation des phospholipides, réduit la viabilité des cellules cancéreuses (humaines et murines), et déclenche des signatures moléculaires typiques de la ferroptose. Les effets sont inhibés par des agents anti-ferroptotiques (comme l’α-tocophérol ou les chélateurs du fer), mais non par des inhibiteurs de l’apoptose.
En réponse au stress induit par Fento-1, les cellules modifient leur phénotype, exprimant des marqueurs épithéliaux et réduisant les marqueurs mésenchymateux de l’EMT, suggérant une adaptation cellulaire. Ces résultats indiquent que l’activation pharmacologique du fer lysosomal est une stratégie prometteuse pour induire la ferroptose de manière ciblée dans les cellules cancéreuses.
C’est cette hypothèse que les auteurs ont ensuite testées en évaluant les effets de l’activation du fer lysosomal sur la croissance tumorale dans des modèles cliniquement pertinents de cancers agressifs comme le pancréas (PDAC), sarcomes et cancer du sein métastatiques. Ces types de cancers, souvent résistants aux traitements standards, présentent un contenu en fer total plus élevé que les tissus sains adjacents, en particulier dans les cellules exprimant fortement CD44.
Le composé Fento-1 a ciblé spécifiquement ces cellules exprimant fortement CD44, entraînant l’oxydation des lipides membranaires, la réduction de leur viabilité et une diminution de leur proportion dans les tumeurs. Ces effets ont été inhibés par des bloqueurs de la ferroptose, confirmant le mécanisme d’action de Fento-1.
Fento-1 s’est montré plus efficace que les chimiothérapies classiques dans les cellules primaires de PDAC et les organoïdes dérivés de tumeurs humaines, et a agi en synergie avec ces traitements. Il a également éliminé les cellules résistantes (DTP) de cancer du sein triple négatif après traitement par doxorubicine, suggérant que la résistance à cette chimiothérapie s’accompagne d’une sensibilité accrue à la ferroptose via l’augmentation de CD44.
Enfin dans un modèle murin de cancer mammaire métastatique, l’administration intralymphatique de Fento-1 a réduit la croissance tumorale dans les ganglions lymphatiques sans effets secondaires notables. L’analyse des tumeurs résiduelles a montré que Fento-1 cible préférentiellement les cellules CD44 positives, riches en fer lysosomal actif, provoquant la peroxydation des lipides et la mort cellulaire.
Ce travail majeur ouvre la voie à une nouvelle génération de traitements anti-cancéreux basés sur l’activation ciblée du fer. Mais il permet aussi de mieux comprendre et appréhender les mécanismes de résistances aux traitements. De plus, il met en avant, une stratégie prometteuse, en particulier pour les cancers de mauvais pronostics, métastatiques ou récidivants.